Enzimas: as proteínas operárias que fazem a vida funcionar e movimentam um mercado bilionário
- Ruann de Castro
- 8 de set. de 2020
- 6 min de leitura
Atualizado: 21 de dez. de 2022
Autoria: Enylson Xavier Ramalho (enylsonramalho@gmail.com). Revisão: Weysser Felipe Cândido de Souza (weysserfelipe18@gmail.com), Ruann Janser Soares de Castro (ruann@unicamp.br) e Andre Ohara (andre.ohara@gmail.com).
A existência da vida como conhecemos depende de uma série ininterrupta de reações químicas que não ocorrem espontaneamente nas condições de temperatura e pH da maioria dos seres vivos. Todavia, essas reações são mediadas por incríveis moléculas conhecidas como enzimas.
Enzimas são macromoléculas de natureza proteica que possuem propriedades catalíticas: aceleram de um milhão a um trilhão de vezes reações químicas específicas. Ou seja, sem enzimas trabalhando a todo vapor, reações importantíssimas de transformação, síntese e degradação de moléculas não aconteceriam nos organismos vivos.

As enzimas convertem moléculas, denominadas substrato, em outras, denominadas produto. Existem diversas enzimas, cada uma com uma função altamente específica para a reação que catalisam. Essa especificidade se deve às características da região da enzima à qual o substrato se liga, denominada sítio ativo. Ao fim da reação, a enzima se restaura ficando disponível para catalisar outra reação, podendo fazer isso milhares de vezes por segundo. O esquema abaixo ilustra como ocorre a interação entre enzima e substrato para a geração do produto.

Síntese e atuação de enzimas: uma engenharia microscópica
Algumas transformações que ocorrem nos organismos vivos envolvem inúmeras enzimas, como no processo de respiração celular, que converte glicose e gás oxigênio em gás carbônico, água e energia. Esse processo consiste em diversas etapas e cada uma ocorre com a participação de várias enzimas. Mas como todas essas enzimas são produzidas?
As enzimas são produzidas no interior das células de todos os seres vivos (bactérias, protozoários, fungos, plantas e animais) por uma complexa e robusta engenharia de síntese proteica que é codificada pelo material genético e por ele executada com participação de enzimas preexistentes. Prontas, as enzimas podem atuar dentro das células ou ser secretadas para agir em outro lugar. Por exemplo, no caso dos seres humanos: algumas enzimas são distribuídas pelo corpo por meio do sangue; outras são produzidas pelas glândulas salivares e estão presentes na saliva para dar início à digestão de carboidratos ainda na boca; já as paredes do estômago liberam enzimas que iniciam a digestão de proteínas; e muitas das enzimas digestivas que agem no intestino são produzidas no pâncreas e outras pela microbiota intestinal. A propósito, a maioria dos micro-organismos secretam suas enzimas digestivas no ambiente, ou seja, a digestão acontece no meio externo e esses seres absorvem as moléculas mais simples por difusão.
Falando no processo de digestão, este consiste na quebra de moléculas grandes em seus constituintes simples para que sejam absorvidos pelo organismo e utilizados tanto para a obtenção de energia quanto para a síntese de outras macromoléculas. Nesse sentido, uma das classificações das enzimas é feita de acordo com a molécula em que ela atua. Por exemplo: as proteases quebram as proteínas liberando peptídeos e aminoácidos simples; as lipases quebram óleos e gorduras liberando ácidos graxos e outros componentes; as carboidrases quebram os carboidratos em açúcares simples, como as amilases que quebram o amido e as celulases que quebram a celulose, ambos liberando unidades de glicose.
Vamos verificar a ação de enzimas na prática no nosso dia a dia?
Mastigue um pedaço de pão por um tempo e preste atenção em como o sabor irá mudar gradualmente. Ficará mais adocicado pois o amido, uma grande molécula sem sabor, será convertido em maltose, dissacarídeo de glicose com sabor adocicado, pela ação das amilases salivares.
Um experimento visual consiste em colocar uma fatia de abacaxi fresco sobre gelatina. A gelatina, produto derivado da proteína colágeno, começará a derreter pois o abacaxi é rico em uma protease chamada bromelina.
Outro experimento consiste em observar o amadurecimento pós-colheita de algumas frutas, como o mamão ilustrado abaixo. Nota-se a perda da coloração verde, pela degradação da clorofila, e a síntese de pigmentos amarelos.

Essas e outras transformações ocorrem em decorrência da ação de diversas enzimas que continuam ativas na fruta após a colheita. Por exemplo, em relação ao sabor, quanto mais madura, mais doce será a fruta. Isso ocorre devido ao consumo das reservas de amido e de frutanos, dos quais enzimas liberam, moléculas de glicose e de frutose, que são açúcares simples de sabor adocicado e facilmente metabolizadas pelas células. Boa parte da glicose e da frutose ainda é convertida em sacarose por outras enzimas. Este dissacarídeo também possui sabor adocicado e está presente em grandes quantidades em frutas maduras, conforme observa-se no gráfico abaixo que apresenta a composição da banana em função das quantidades de amido, açúcares simples e sacarose em diferentes fases de maturação. A sacarose é o açúcar de mesa comum, obtido aqui no brasil da cana-de-açúcar.
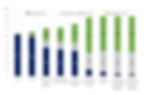
Composição da banana em diferentes estágios de maturação classificados pela cor da casca (LII, 1982)
Sendo assim, diferentes frutas, legumes e verduras em diferentes estágios de amadurecimento, apresentam diferentes teores de açúcares simples e, consequentemente, diferentes níveis de sabor adocicado.
Aplicações industriais: soluções com muito dinheiro envolvido
A capacidade catalítica das enzimas é adequada para muitas aplicações tecnológicas, uma vez que, em condições de armazenamento adequadas, elas continuam ativas mesmo fora das células. Por serem biodegradáveis, específicas, eficientes e atóxicas, além de atuarem em condições operacionais amenas, as enzimas são uma alternativa sustentável e viável aos tradicionais processos ácidos e alcalinos. Há algumas limitações que restringem o uso dessas moléculas, como sensibilidade a variações de temperatura e pH, presença de inibidores, custo de produção e impossibilidade de reciclagem, contudo diversas estratégias têm sido desenvolvidas para driblá-las.
Para serem utilizadas, as enzimas precisam ser extraídas de seres vivos. Embora existam enzimas comerciais de origem vegetal e animal, as enzimas microbianas dominam o mercado. Isso ocorre devido a simplicidade dos micro-organismos possibilitar a produção e purificação de grandes quantidades de enzimas mais estáveis, de forma barata e rápida e ainda há a possibilidade de modificá-los geneticamente para apresentarem as características desejadas.
Os micro-organismos também podem ser aplicados diretamente na transformação de substratos, em um processo conhecido como fermentação. Os compostos de interesse são produzidos pela ação das enzimas por meio das vias metabólicas do micro-organismo, de forma integrada ao seu desenvolvimento no meio de cultivo, ou seja, como parte do seu ciclo de vida.
Após a elucidação dos processos fermentativos e do papel das enzimas, a partir do século XIX, houve uma verdadeira revolução: muitos itens passaram a ser produzidos em larga escala e diversos produtos inovadores foram desenvolvidos, inclusive importantes medicamentos. Assim, a vida se tornou mais segura e prática. Hoje, a aplicação industrial de enzimas já está bem consolidada mundialmente, estando presentes em diversos segmentos: alimentos, detergentes, fármacos, cosméticos, papel e celulose, tecidos e biocombustíveis.
O mercado de enzimas foi estimado em US$ 10,0 bilhões em 2019 e deve atingir US$ 14,7 bilhões até 2025. Tal crescimento se dá devido à evolução das tecnologias de DNA recombinante e engenharia de proteínas para produção de enzimas mais eficientes, como também ao esgotamento dos recursos não renováveis e a um aumento das preocupações ambientais, dentre outras razões (Enzymes Market, 2020).
Dando ênfase à indústria alimentícia, há uma infinidade de produtos obtidos por fermentação microbiana ou por tratamento com enzimas isoladas, ou ainda pela combinação de ambos, com o intuito de se produzir alimentos mais nutritivos, saborosos, digestíveis e atraentes.
Aliás, alimentos fermentados como pão, queijo e cerveja, existem há milhares de anos, desde os primórdios da humanidade, sendo produzidos empiricamente. Muitas culturas atribuíam os mecanismos de transformação desses alimentos à intervenção de divindades. Algumas aplicações em alimentos são:
Proteases: amaciamento de carne, produção de proteína hidrolisada, coagulação do leite, maturação de queijo;
Amilases: produção de xaropes, sacarificação do amido, panificação;
Pectinases: clarificação e extração de sucos;
Celulases: solubilização de parede celular vegetal, produção de açúcares disponíveis.
Curiosidade: alimentos lácteos sem lactose
A indústria também tem se atentado ao aumento das intolerâncias e alergias alimentares. Por exemplo, uma das mais comuns é a intolerância à lactose, onde, em algum momento da vida, a pessoa passa a produzir pouca ou nenhuma lactase, que é a enzima que degrada a lactose em glicose e galactose. Conseguimos absorver facilmente estes açúcares simples, porém a lactose inalterada não. Assim, no indivíduo intolerante, a lactose se acumula no intestino grosso e acaba sendo fermentada pelas bactérias ali presentes que fabricam ácido lático e gases, promovendo maior retenção de água e o surgimento de diarreias, cólicas, flatulências, dentre outros sintomas.
E como a indústria está resolvendo esse problema? Adicionando a enzima nos produtos lácteos. Um produto sem lactose definitivamente foi tratado com lactase. Ou seja, nesse processo industrial é feito o processo que o organismo dos intolerantes não consegue fazer: a lactose é digerida em glicose e galactose, o que confere um sabor ligeiramente mais doce ao produto, sendo essa a única alteração significativa, havendo a manutenção dos valores calórico e nutricional. Os produtos sem lactose têm se tornado muito comuns e estão cada vez mais presentes nas gôndolas dos supermercados.
Deu para perceber o quão vasto é o universo das enzimas, né? Muito se avançou em ciência, tecnologia e engenharia de enzimas, mas ainda há um gigantesco potencial a ser explorado, seja em novas aplicações e na descoberta de novas enzimas, seja na otimização dos processos já estabelecidos. O que esperar dessas incansáveis operárias? Tudo e qualquer coisa!
Para mais informações sobre os nossos trabalhos e atividades de pesquisa, conecte-se com a gente através do site ou de nossas redes sociais.


